כתבה: נעמי כהן דוד
ייעוץ רפואי: פרופ' סאלם בלאן, מנהל מכון רדיותרפיה, המרכז האונקולוגי ע"ש פישמן
פורסם: 11.8.2024
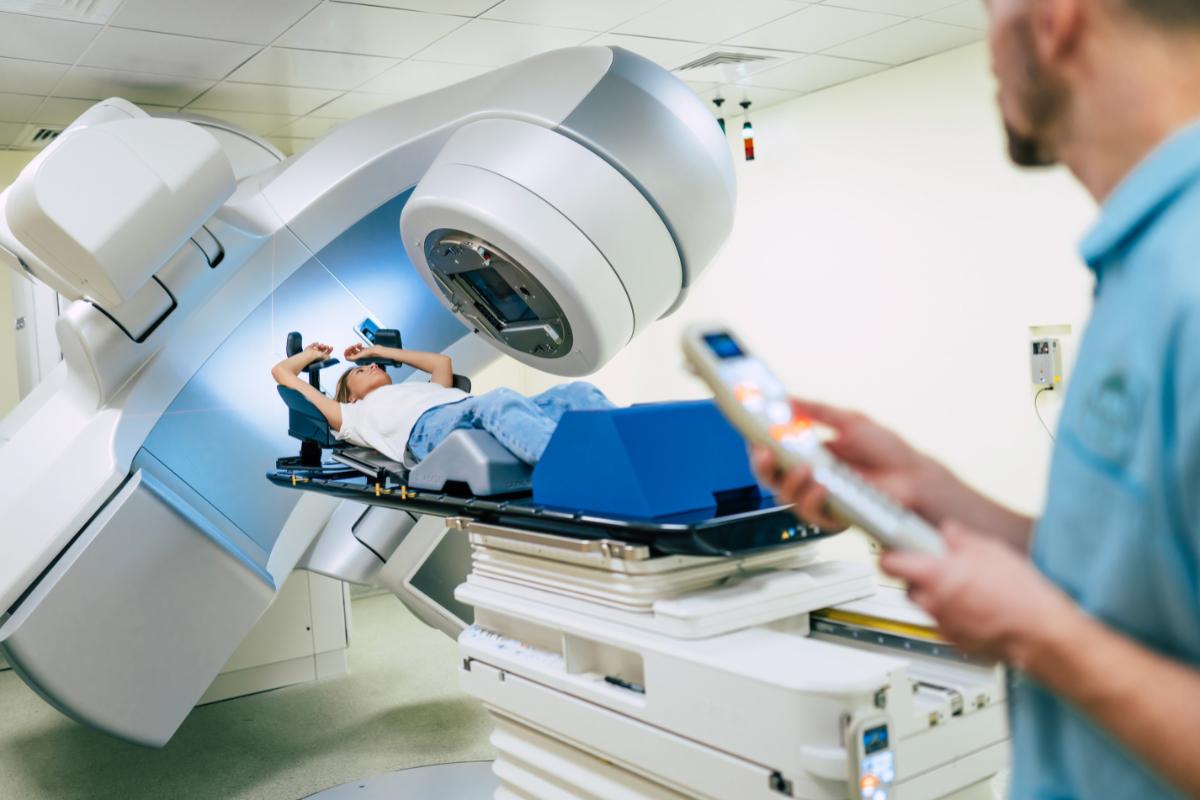
רדיותרפיה, או טיפול בקרינה, היא שיטה רפואית המשמשת לטיפול במחלות שונות, בעיקר במחלת הסרטן. במהלך הטיפול, נעשה שימוש בקרינה מייננת בעלת אנרגיה גבוהה, כמו קרני רנטגן או קרינת גמא מפירוק רדיואקטיבי של גרעיני אטומים, על מנת להרוג תאים סרטניים. הקרינה יוצרת רדיקלים חופשיים אשר פוגעים ב-DNA של התאים, מונעת מהם להתרבות וגורמת למותם. הקרינה יכולה להיות חיצונית (EBRT), כלומר מחוץ לגוף המטופל או קרינה פנימית (ברכיתרפיה) עליה נפרט בהמשך). הטיפול בקרינה חיצונית מתבצע באמצעות מכשיר שנקרא מאיץ קווי המפיק קרינה בעלת אנרגיה גבוהה.
מרבית חולי הסרטן יזדקקו בשלב מסוים לטיפול קרינתי. במרבית המקרים הטיפול ניתן עד חמש פעמים בשבוע למשך מספר שבועות בהתאם למינון שקבע רופא הקרינה. כל טיפול נקרא מקטע (Fraction). עם ההתקדמות הטכנולוגית ודיוק הטיפול, מספר מקטעי הקרינה ירד בצורה משמעותית והמנה למקטע עלתה בצורה משמעותית (לדוגמא, טיפול קרינתי משלים לסרטן השד ניתן בהתחלה ב- 33 טיפולים/מקטעים, לאחר מכן ב- 18מקטעים ולאחרונה, רוב המטופלות מקבלות 5 מקטעי קרינה בלבד). משך מתן כל טיפול קרינתי קצר מאד, אך זה לא אומר שלא תשכבו מספר דקות במהלך הטיפול באותה תנוחה מאחר ולטכנאי הרנטגן נדרש זמן כדי למקם במדויק את מכשיר הקרינה באזור המתאים.
סוגי קרינה
הקרינה המשמשת ברדיותרפיה מחולקת לשתי קטגוריות עיקריות:
1. קרינת פוטונים: קרינת X או קרינת גמא (המבדיל בין הסוגים הוא מקור הקרינה)
קרני X: בטיפול הקרינה המקור הוא מאיץ קווי (LINAC). קרני ה-X (רנטגן) בעלות אנרגיה גבוהה חודרות לרקמות הגוף ופוגעות בתאים הסרטניים.
קרינת גמא: מקורה בפירוק רדיואקטיבי של גרעיני אטומים. משמשת בעיקר בברכיתרפיה אך ניתן להשתמש בה גם בקרינה חיצונית.
2. קרינת חלקיקים
אלקטרונים: בעלי יכולת חדירה מוגבלת יחסית, ולכן משמשים לטיפול בגידולים שטחיים או בעומק רדוד. לרוב בגידולי עור.
פרוטונים: בעלי יכולת חדירה גבוהה, ולהבדל מהפוטונים, הפרוטון עוצר בגידול עצמו, כך שנחסכת מנת קרינה לרקמות הבריאות. למעשה, הטיפול מדויק יותר, עם פחות תופעות לוואי.
יונים כבדים: חלקיקים כבדים מאוד (כגון פחמן או חמצן) בעלי יכולת חדירה גבוהה במיוחד. הפעילות שלהם לא תלויה בחימצון הרקמה (כמו הפוטונים והפרוטונים) ולכן משתמשים בהם כיום לגידולים עמידים לקרינה (גידולים היפוקסיים, המתפתחים בתנאים של אספקת חמצן ירודה), כמו גידולים של בלוטות הרוק.
בחירת סוג הקרינה תלויה במספר גורמים, ביניהם: סוג הגידול, מיקומו, גודלו ומצב בריאותו הכללי של המטופל.
מהן מטרות הטיפול הקרינתי?
- טיפול דפיניטיבי (ריפוי מלא): הטיפול הקרינתי הוא הטיפול העיקרי כמו בגידולי ראש צוואר, גידולי צוואר הרחם, גידולי ערמונית, גידולי התעלה האנאלית ועוד.
- טיפול טרום ניתוחי: הטיפול ניתן לפני ניתוח במטרה להקטין את הגידול ולשפר את הבקרה המקומית. למשל, בסרטן החלחולת וסרקומה.
- טיפולי משלים (לאחר ניתוח): הטיפול ניתן כדי להקטין את הסיכוי לחזרת מחלה ולשפר את ההישרדות. למשל, בסרטן שד
- טיפול פליאטיבי: הטיפול ניתן במטרה להפחית כאבים או להפחית דימום מהגידול או למנוע הדרדרות עצבית כמו שיתוק במקרה של לחץ על חוט השדרה.
- טיפול משולב: בגידולים מסוימים, למשל בגידולי ראש צוואר ובגידולי צוואר הרחם, שילוב של טיפול כימותרפי בכמות קטנה לטיפול הקרינתי גורמת לעליה ברגישות התאים הממאירים לקרינה ולתוצאות קליניות טובות יותר.
סוגי הטיפולים (טכנולוגיות)
- ברכיתרפיה: טיפול בקרינה שבו מקור הקרינה מוחדר ישירות לחללים או לרקמות באזור הגידול.
https://www.rambam.org.il/treatments-and-examinations/oncology/radiation_therapy_brachytherapy/
- רדיותרפיה מאופננת עוצמה IMRT (Intensity Modulated RadioTherapy) היא טכניקת הקרנות מתקדמת המאפשרת טיפול מדויק וממוקד יותר בגידולים סרטניים, תוך מזעור הנזק לרקמות בריאות הסמוכות או לאיברים רגישים. זה לא תמיד היה כך. "עד תחילת שנות ה-2000, תכנון ההקרנות היה מתבצע בטכניקת 2D, כלומר בצורה דו- מימדית", מפרט פרופ' סאלם בלאן, "הקרינה ניתנה משני צידי המטופל , כך שכל הרקמות הסמוכות לגידול היו סופגות את מלוא מנת הקרינה, ללא הבדל בין הגידול עצמו לבין רקמה בריאה או איברים רגישים. כתוצאה מכך, היו לטיפולים תופעות לוואי קשות מאוד, כולל מוות. אזור הראש והצוואר, למשל, נחשב למסובך בתחום הקרינה, כי הוא כולל מספר רב של איברים רגישים ובצפיפות גבוהה (עיניים, אוזניים, בלוטות רוק, עצבים חשובים ועוד). כל הקרנה באזור זה עלולה לגרום לתופעות לוואי קשות מאוד".
לדבריו, שיטת IMRT, שהוכנסה לשימוש בעשור וחצי האחרונים, המבוססת על תכנון מחשב מתקדם, מאפשרת לחלק את שדה הקרינה למספר רב של אלומות, כל אחת בעוצמה ובכיוון שונים, כך שהגידול מקבל את המנה הגבוהה ביותר של קרינה, בעוד הרקמות הבריאות מקבלות מינון נמוך יותר. השיטה מאפשרת להקטין את הפגיעה, בייחוד בבלוטות הרוק ולצמצם בכך את תופעות הלוואי.
אם לא די בכך, בשנה האחרונה הוכנס לשימוש ברמב"ם סימולטור MRI, חידוש טכנולוגי הקיים רק בבית חולים נוסף בארץ מלבד רמב"ם. "השימוש ב-MRI מספק תמונות ברזולוציה גבוהה של הגידול והרקמות הסובבות אותו, ומאפשר תכנון טיפול מדויק אף יותר".https://www.rambam.org.il/treatments-and-examinations/oncology/intensity_modulated_radiotherapy-imrt/
לפני הטיפול
הבינו את הטיפול: אל תהססו לשאול את הרופא המטפל כל שאלה שעולה בדעתכם (למשל, מה הטיפול אמור להשיג? כיצד הוא מתבצע בפועל? מהו משך הטיפול, תדירות הטיפולים והיכן הם יתקיימו? מהן תופעות הלוואי הצפויות וכיצד ניתן להתמודד איתן? מהם הסיכונים הכרוכים בטיפול וכיצד ניתן להפחיתם? מהן ההשלכות ארוכות הטווח של הטיפול? כיצד הטיפול ישפיע על חיי היומיום שלי?).
עברו תכנון קרינה (סימולציה): הסימולציה כוללת: החלטה על צורת השכיבה במהלך הטיפול, סריקת CT, סימון אזור הטיפול על גבי צילומי ה-CT וביצוע מדידות באזור המיועד לטיפול בקרינה. לאחר המדידות, נעשה סימון של נקודות ציון על פני הגוף. בנוסף, יסומנו אזורים שצריך להגן עליהם כדי שלא ייחשפו למנת יתר של קרינה (חוט השדרה, גזע המוח ואיברי הראייה). מחשבים מיוחדים ינתחו את התמונות ויחשבו את המינון האופטימלי של הקרינה שתועבר לכל נקודה בגידול. תכנית הטיפול היא אישית ומותאמת במיוחד לכל מטופל. במהלך הסימון תתבקשו לשכב ללא תנועה. התהליך עשוי להימשך כשעה.
במהלך הטיפול
- תתבקשו להסיר תכשיטים וחפצים מתכתיים לפני התחלת הטיפול.
- תשכבו על מיטת הטיפול ותתבקשו לשמור על תנוחה זהה לתנוחה שהייתה בתכנון קרינה.
- מכשיר הקרינה יכוון אל האזור המטופל וישחרר אלומת קרינה למשך מספר דקות. רנטגנאי הטיפול ישגיח על מהלך הטיפול מחוץ לחדר בעזרת טלוויזיה במעגל סגור. הטיפול יתבצע ללא הרדמה והוא אינו כרוך בכאב. חשוב מאוד שלא תזוזו במהלכו. גם תנועה קטנה עלולה להשפיע על דיוק הטיפול.
לאחר הטיפול
הטיפול כרוך לעיתים בתוצאות שאינן נעימות. חלקן עוברות או נחלשות עם הזמן.
תופעות לוואי נפוצות
עייפות: עשויה להחמיר במהלך הטיפול ולשכוך בהדרגה לאחר סיומו.
שינויים בעור: האזור המוקרן עשוי להאדים, להתקלף, לגרד או לכאוב. תופעות אלו דומות לכוויות שמש וחולפות, בדרך כלל, לאחר סיום הטיפול.
בחילות והקאות: תופעות אלו שכיחות במיוחד כאשר מטפלים באזור הבטן או האגן.
נשירת שיער: במקרים שההקרנה לאזור הקרקפת. השיער, בדרך כלל, יצמח בחזרה לאחר סיום הטיפול.
שינויים בטעם וריח
קושי בבליעה: בעיקר במקרים בהם הקרינה מכוונת לאזור הראש והצוואר.
שלשולים: תופעה שכיחה בעיקר כאשר הקרינה מכוונת לאזור האגן.
שינויים במצב הרוח: עייפות, כאב, שינויים בהרגלים ואי ודאות לגבי העתיד עלולים להשפיע על מצב הרוח ולגרום לתחושות של דיכאון או חרדה.
תופעות לוואי נדירות
הפרעות זיכרון: בעיקר לאחר קרינה לאזור המוח.
הפרעה בזקפה: לאחר קרינה לערמונית.
פיברוזיס (היווצרות רקמת צלקת באזור המוקרן).
סיכון מוגבר, נמוך יחסית, לסרטן שניוני.